上海交大生命学院邓子新团队揭示蛋白识别DNA硫原子的机制
近日,上海交通大学生命科学技术学院、微生物代谢国家重点实验室邓子新团队的贺新义研究员与上海交大生命学院吴更教授合作,共同揭示了一类识别DNA硫原子的蛋白结构域,并对其识别硫原子的机制及其偶联的核酸酶结构域活性进行了深入研究,相关成果分别发表在《Nature Communications》和《Molecular Microbiology》上。
硫原子被发现存在于生物分子,如蛋白质、tRNA、铁硫簇、抗生素等分子结构中已超过一个多世纪。2005-2007年期间,我国科学家邓子新院士发现并报导了细菌DNA中存在天然的硫修饰,其化学结构是在特定的DNA磷酸二酯键骨架上的氧-硫替换,这是国际上迄今为止在生物体中发现的唯一一种DNA骨架上的表观遗传修饰。众所周知,DNA结构上细微的改变或修饰影响生命体代谢过程,比如DNA的甲基化修饰与基因表达、细胞分化、癌症发生等息息相关。这些DNA修饰依赖一类特异性的蛋白质对其识别解码(Reader)。DNA硫修饰作为DNA骨架上的修饰,参与了细菌的限制-修饰和抗氧化过程。那么,是否存在一类能够解读这种全新修饰的“Reader”呢?2010年,贺新义研究组曾在天蓝色链霉菌中发现一个DNA硫修饰依赖型的IV限制酶ScoMcrA,只有当DNA被硫化修饰后,才会被识别并被切割(Liu et al., PLoS Genetics)。但关于能特异性识别生物分子上硫原子的蛋白结构域还没有一例相关报导。
.png)
图1:DNA硫修饰可以被Reader蛋白ScoMcrA所识别
.png)
图2:ScoMcrA采用SBD结构域表面上的一个疏水坑,特异性识别硫修饰DNA上的硫原子
为揭示ScoMcrA特异性识别硫修饰DNA的作用机制,贺新义研究组与吴更团队经过数年深入探索,成功解析了ScoMcrA-硫修饰DNA复合物的蛋白晶体结构,发现硫原子被巧妙包埋于其中一个保守结构域(Sulfur Binding Domain, SBD)的浅表疏水坑中。与氧原子相比,硫原子具有更大的原子半径,导致其对外层电子的吸引作用明显减弱,呈现出较弱的电负性,赋予硫原子疏水的特性。SBD正好利用这个细微差异来区分硫修饰DNA和普通DNA(图1, 2)。该部分成果发表在《Nature Communications》上,刘光博士(现任职于华东理工大学)是第一作者,贺新义研究员和吴更教授为共同通讯作者。
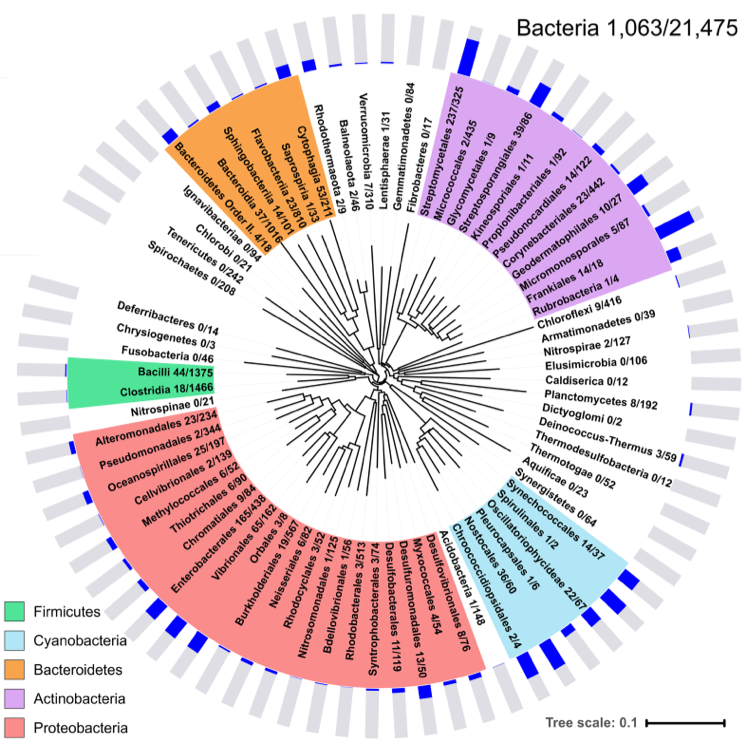
图3:SBD结构域在多达十四个门的一千种以上已测序细菌中存在同源蛋白
在此基础上,研究小组进一步分析发现SBD结构域在多达十四个门的一千种以上已测序细菌中存在同源蛋白,说明这种硫修饰识别蛋白在细菌中广泛存在。他们对其中一类最小的同源蛋白SprMcrA进行详细的体内和体外活性表征试验,并对其关键活性位点进行突变,使该蛋白切割硫修饰DNA的效率提高了30倍。本研究成果极大地推进了硫修饰依赖型的识别蛋白在核酸体外检测或发展成为基因编辑工具方面的应用。该部分工作发表在微生物学权威杂志《Molecular Microbiology》上,博士生于昊为第一作者,贺新义研究员为通讯作者。
该项工作还得到了上海交通大学赵一雷教授和沙特阿卜杜拉国王大学何尧教授的帮助。国家自然科学基金(31130068,31670034)以及上海交通大学科技创新专项资金对以上工作进行了资助。
论文链接:
https://www.nature.com/articles/s41467-018-07093-1
https://www.ncbi.nlm.nih.gov/pubmed/30184284
Copyright © 2016上海交通大学分子微生物学研究室
地址:上海市华山路1954号上海交通大学哲生馆(原科学馆) 电话:021-62932943
